Trodelvy
Zkrácená informace o léčivém přípravku 

Jsem odborníkem ve smyslu §2a Zákona č. 40/1995 Sb., o regulaci reklamy, ve znění pozdějších předpisů, čili jsem osobou oprávněnou předepisovat léčivé přípravky nebo osobou oprávněnou vydávat léčivé přípravky.

Zvláštní upozornění a opatření pro použití zahrnují zpětnou sledovatelnost, neutropenii, průjem, hypersenzitivitu, nauzeu a zvracení, použití u pacientů se sníženou aktivitou UGT1A1 a embryofetální toxicitu.
Přípravek Trodelvy je v monoterapii indikován k léčbě dospělých pacientů s neresekovatelným nebo, metastazujícím triple-negativním karcinomem prsu (mTNBC), kteří podstoupili dvě nebo více předchozích systémových terapií z nichž alespoň jedna byla na pokročilé onemocnění.¹
 Tento léčivý přípravek podléhá dalšímu sledování. Odkaz na zkrácenou informaci o přípravku TRODELVY najdete výše. Pro kompletní informace o zvládání nežádoucích účinků si prosím přečtěte souhrn údajů o přípravku.
Tento léčivý přípravek podléhá dalšímu sledování. Odkaz na zkrácenou informaci o přípravku TRODELVY najdete výše. Pro kompletní informace o zvládání nežádoucích účinků si prosím přečtěte souhrn údajů o přípravku.
*ASCENT bylo mezinárodní, multicentrické, otevřené, randomizované klinické hodnocení fáze 3 u pacientů s neresekovatelným lokálně pokročilým nebo metastatickým TNBC (n = 529). Pacienti byli randomizováni v poměru 1:1, a to buď k léčbě přípravkem TRODELVY 10 mg/kg i.v. v den 1 a den 8 21denního cyklu nebo k chemoterapii dle výběru lékaře (eribulin, vinorelbin, gemcitabin nebo kapecitabin). Primárním cílovým parametrem účinnosti bylo PFS u pacientů bez mozkových metastáz při vstupu do klinického hodnocení (88 % z celkové studijní populace), podle měření BICR 75 využívajících kritéria RECIST v1.11
†Zlepšení PFS a OS u populace pro primární analýzu byla konzistentní s ITT populací (medián PFS: 5,6 měsíců vs. 1,7 měsíců; HR: 0,41; p < 0,0001; medián OS: 12,1 měsíců vs. 6,7 měsíců; p < 0,0001).¹
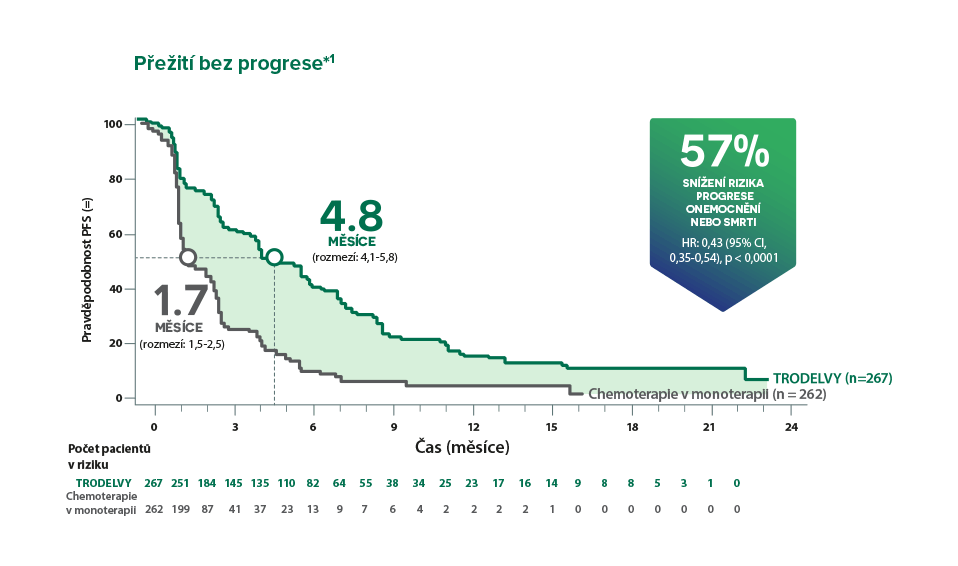
*Zlepšení PFS u populace pro primární analýzu bylo konzistentní s ITT populací (medián PFS: 5,6 měsíce vs. 1,7 měsíce; HR: 0,41; p < 0,0001). Populace pro primární analýzu zahrnovala pacienty bez mozkových metastáz při vstupu do studie (n = 468). ITT populace zahrnovala pacienty s nebo bez mozkových metastáz při vstupu do klinického hodnocení (n = 529).4
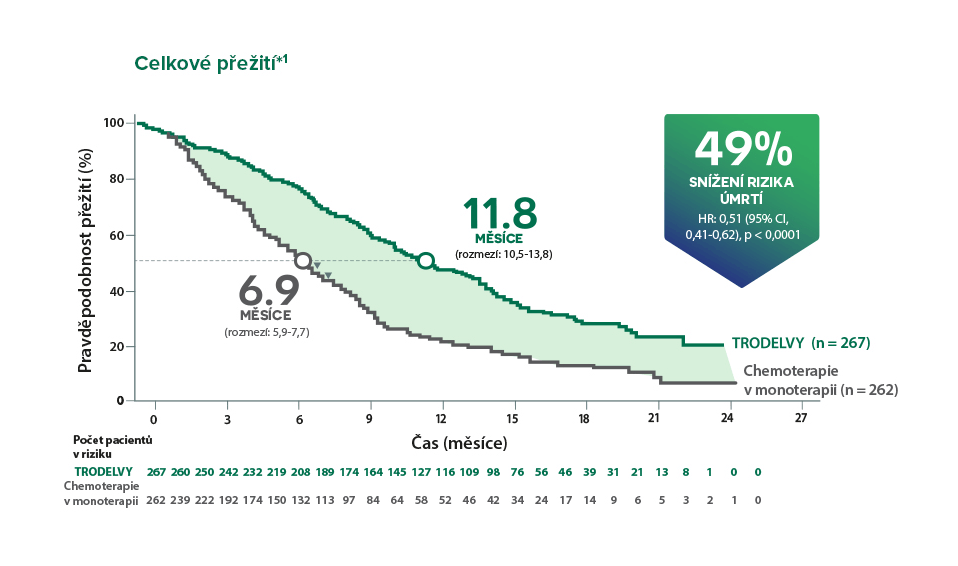
Zlepšení OS v rameni s přípravkem TRODELVY u pacientů s jednou předchozí linií léčby pro metastatické onemocnění bylo konzistentní s výsledky u celkové populace; HR: 0,514 (95% CI, 0,28-0,91).+1,2
*Zlepšení OS u populace pro primární analýzu bylo konzistentní s ITT populací (medián OS: 12,1 měsíce vs. 6,7 měsíce; HR: 0,48; p < 0,0001). Populace pro primární analýzu zahrnovala pacienty bez mozkových metastáz při vstupu do studie (n = 468). ITT populace zahrnovala pacienty s nebo bez mozkových metastáz při vstupu do klinického hodnocení (n = 529).¹ †Post-hoc analýza populace pro primární analýzu.
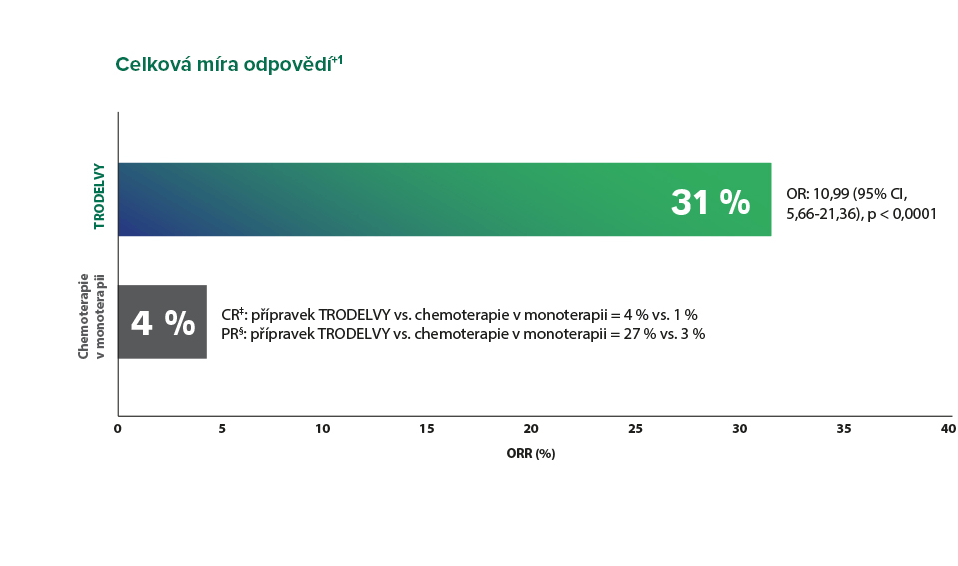
Medián trvání odpovědi byl 6,3 měsíce v rameni s přípravkem TRODELVY (rozmezí: 5,5-9,0) vs. 3,6 měsíce se samotnou chemoterapií (rozmezí: 2,8-NE).¹
*Podle Tabulky 4 souhrnu údajů o přípravku obsahující míru objektivních odpovědí u přípravku TRODELVY a samotné chemoterapie.
†Výsledky ORR u populace pro primární analýzu byly konzistentní s ITT populací (ORR: 35 % vs. 5 %; OR: 10,86; 95% CI, 5,59-21,0). Populace pro primární analýzu zahrnovala pacienty bez mozkových metastáz při vstupu do klinického hodnocení (n = 468). ITT populace zahrnovala pacienty s nebo bez mozkových metastáz při vstupu do klinického hodnocení (n = 529).¹
‡Kompletní odpověď (CR): vymizení všech cílových lézí. Všechny patologické lymfatické uzliny (cílové i necílové) se musí zmenšit v krátké ose na <10 mm.⁵
§Částečná odpověď (PR): zmenšení součtu průměrů cílových lézí alespoň o 30 % vzhledem k vstupnímu součtu jejich průměrů.⁵
PŘÍPRAVEK TRODELVY: NEJČASTĚJŠÍ NEŽÁDOUCÍ ÚČINKY1

Zvláštní upozornění a opatření pro použití zahrnují zpětnou sledovatelnost, neutropenii, průjem, hypersenzitivitu, nauzeu a zvracení, použití u pacientů se sníženou aktivitou UGT1A1 a embryofetální toxicitu.

Zkrácená informace o léčivém přípravku TRODELVY k dispozici ZDE.
 Obsah
Obsah
2L+, druhá a vyšší linie; předchozí léčby; ADC, konjugát protilátka-léčivo; BICR, zaslepená, nezávislá, centralizovaná kontrolní skupina radiologů; CI, interval spolehlivosti; HR, poměr rizik; HRQoL, kvalita života související se zdravím; ITT, se záměrem léčit; i.v., intravenózní; mTNBC, metastatický triple-negativní karcinom prsu; NE, neodhadnutelné; NÚ, nežádoucí účinek; OR, poměr šancí; ORR, míra objektivních odpovědí; OS, celkové přežití; PFS, přežití bez progrese; PR, částečná odpověď; RECIST, kritéria hodnocení onkologické odpovědi u solidních tumorů; TNBC, triple-negativní karcinom prsu; Trop-2, trofoblastický povrchový antigen 2; QoL, kvalita života; UGT1A1, uridindifosfát glukuronosyltransferáza 1A1.
Reference:
1. SPC Trodelvy.
2. Loibl S, et al. Eur J Cancer. 2023;178:23-33.
3. Rugo H, et al. Poster. SABCS [virtual meeting]. 2020 (abstr PS11- 09).
4. Bardia A, et al. N Engl J Med. 2021;384(16):1529-1541.
5. Eisenhauer EA, et al. Eur J Cancer. 2009;45(2):228-247
Datum přípravy: září 2023
Schvalovací kód: CS-TRO-0293
Návštěvou našich stránek souhlasíte
s používáním Nastavení souborů cookie
Gilead Sciences s.r.o.
Pujmanové 1753/10a
140 00 Praha 4 – Nusle
IČO: 24268551
© 1996 - 2025 Gilead Sciences s.r.o.
Všechna práva vyhrazena.